運動皮質の神経活動に基づく脳深部刺激によるパーキンソン病治療(適応型DBS)
研究キーワード
パーキンソン病 , 脳深部刺激療法(DBS) , 定位脳手術 , 運動異常症
研究概要
パーキンソン病は、脳の深部にある大脳基底核でドーパミンという物質を作る神経細胞が減少することによって、手足のふるえ、動かしにくさ、強張りなどを起こす神経難病で、患者数は60歳以上では100人に1人と超高齢社会の日本では大きな問題となっています。病気の初期においては、不足しているドーパミンを薬で補う治療法が有効ですが、数年経過すると薬によるコントロールが難しくなります。このような進行期の患者さんに対しては、大脳基底核のうち視床下核という部位に電極を挿入して連続的に電気刺激を加える脳深部刺激療法(DBS)が有効で、日本でも2000年より健康保険適用になっています。しかし、24時間同じ強度と頻度で刺激を行うため、刺激への慣れによる効果の減弱や、比較的早い電池消費(3〜5年ごとに、小手術によって交換する必要があります)などの問題があります。
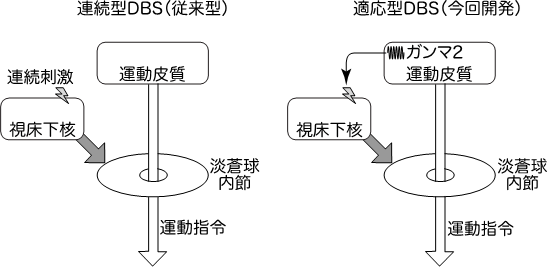
これまでの研究から、パーキンソン病では大脳皮質(運動皮質)から出された運動の指令が大脳基底核でブロックされるため、運動がおこりにくくなっていることや、視床下核の活動を人為的に操作しブロックを解除すると症状が回復することがわかっていました。そこで、運動皮質から運動指令の神経活動を記録し、それに基づいて視床下核のDBSの刺激強度や刺激頻度をコントロールすれば、効率よくパーキンソン病を治療できるのではないかと考えました(図1右)。
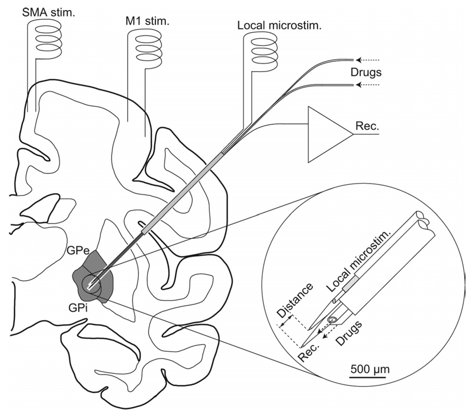
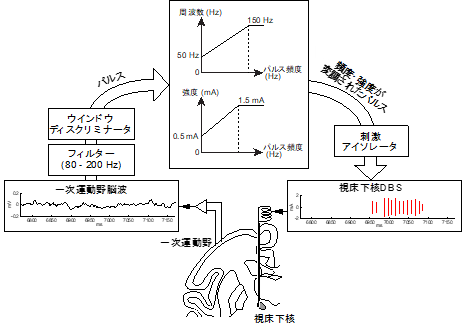
まず、運動皮質の神経活動(皮質脳波)を記録したところ、ガンマ2帯域と呼ばれる80-200 Hzの脳波が運動に関連していることがわかりました。次に、パーキンソン病モデルサルを用いて、視床下核に刺激電極を挿入しました(図2)。刺激を与えない状態では、サルは目標に向かってゆっくりとしか手を伸ばせませんでしたが、従来の連続型DBS(図1左)を加えたところ、手をスムーズに伸ばせるようになりました。次に運動皮質のガンマ2帯域の脳波をもとにDBSの刺激パラメータ(強度と頻度)をコントロールするようにしたところ(図1右、図2)、従来型と同程度、場合によってはより早く手を伸ばせるようになりました。また、従来型に比べて消費電力も約2/3に減少することもわかりました。
これらの結果から、今回新たに開発した運動皮質の運動開始信号に基づきDBSの刺激パラメータをコントロールするという治療法が有効であることがわかり、パーキンソン病に対するDBSの改良につながることが期待されます。
想定される応用先・連携先
定位脳手術を行なっている医療機関、定位脳手術の記録装置•記録電極等を開発・製作・販売している医療機器企業。
アピールポイント
従来の連続型脳深部刺激療法(DBS)に比べて、有効性が同等あるいは優れています。また、従来型に比べて消費電力も約2/3に減少するため、小手術によって交換する頻度を減らすことが期待できます。類似した技術に、視床下核からベータ帯域の神経活動(パーキンソン病の症状が悪化すると増大することが知られています)を記録し、それに基づいて視床下核にDBSを加えるという別の適応型DBSが実用化されています。本発明は、運動に関連した脳活動を記録し、それに基づいて刺激を行うという全く別の発想であるとともに、記録部位と刺激部位が異なるため、刺激のノイズによる誤動作などの心配がない、などの利点があります。
論文情報
Darbin O, Hatanaka N, Takara S, Kaneko N, Chiken S, Naritoku D, Martino A, Nambu A (2022) Subthalamic nucleus deep brain stimulation driven by primary motor cortex γ2 activity in parkinsonian monkeys. Sci Rep 12, 1 DOI: 10.1038/s41598-022-10130-1
関連する特許出願番号・特許番号
出願番号:特願2023-056438 (2023-03-30 出願)